Effects of silver nanoparticles on dissimilatory nitrate reduction in estuarine and tidal sediments
-
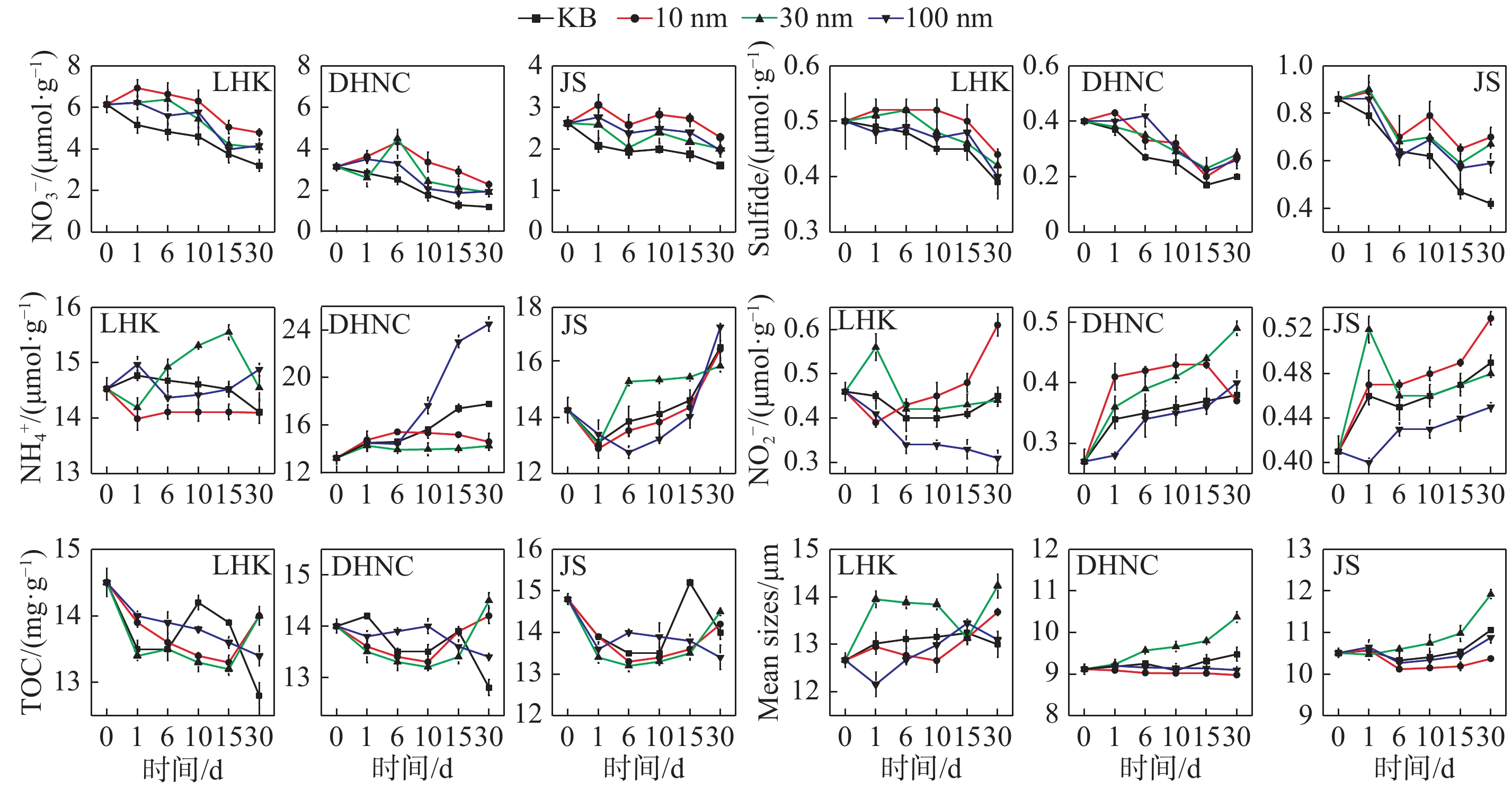
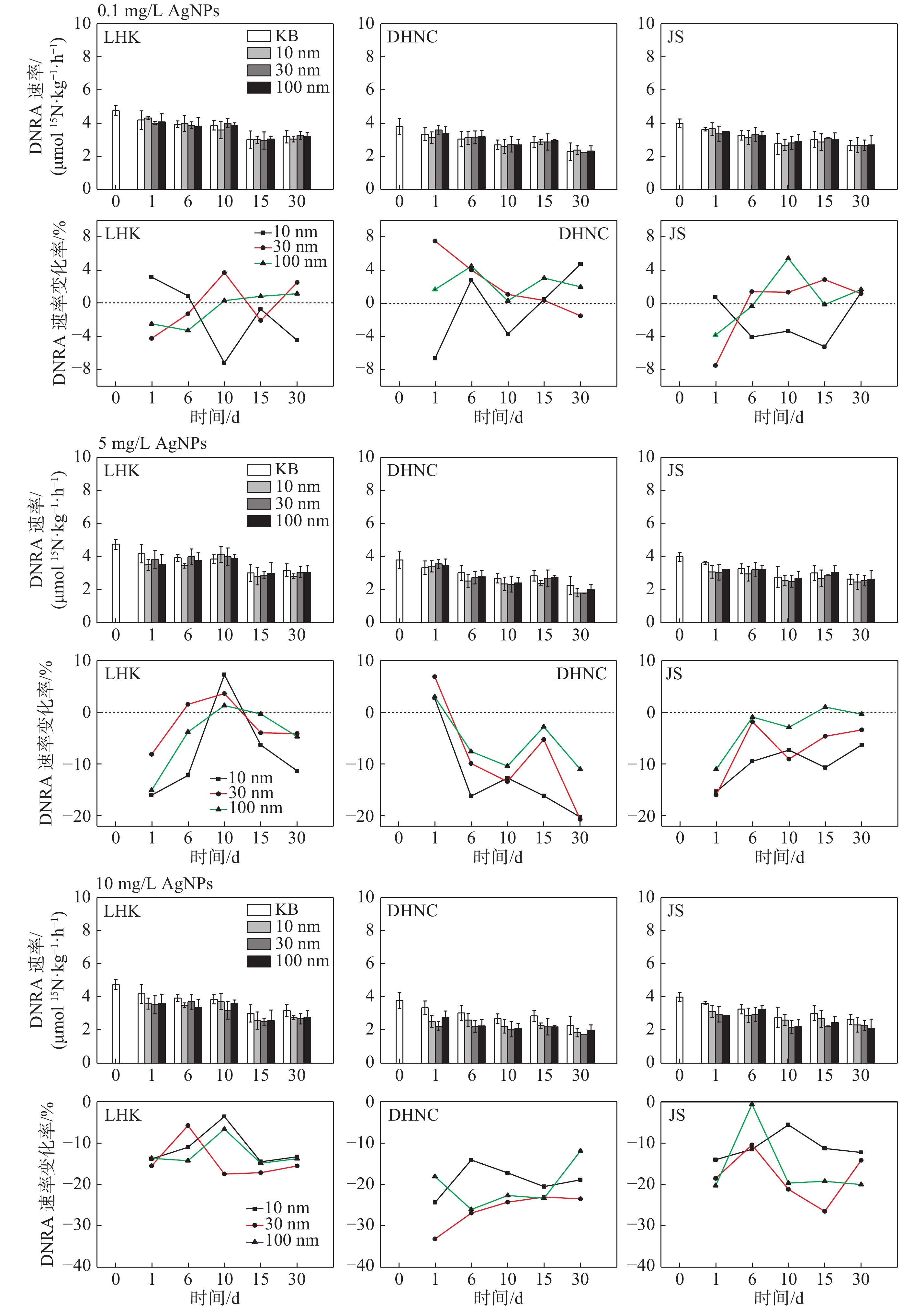
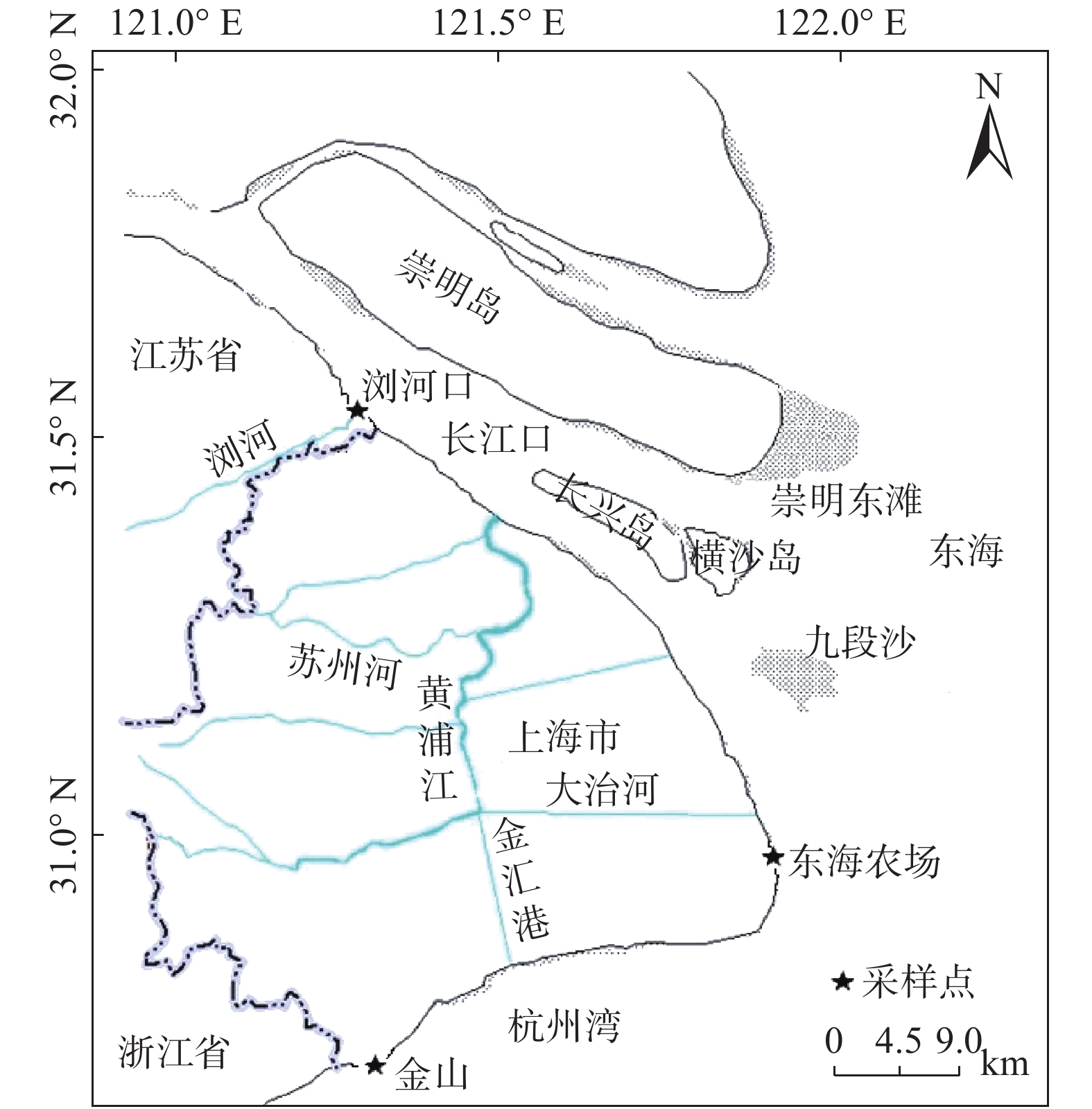
摘要: 人类活动会导致纳米银(AgNPs)毒性污染物在河口海岸环境富集, 但AgNPs赋存和累积对河口氮转化过程的影响尚不清楚. 为此, 以长江口作为研究区域, 对不同粒径(10 nm、30 nm和100 nm)及不同浓度(0.1 mg/L、5 mg/L和10 mg/L) 的AgNPs进行暴露实验, 探究AgNPs对河口潮滩硝酸盐异化还原成铵(DNRA)的影响. 结果表明, 添加AgNPs对不同盐度沉积物DNRA速率均产生一定程度的抑制效应, 但其抑制率并没有随时间增长而明显增大. 受沉积物理化性质的影响, AgNPs对中盐度(8.0‰)沉积物DNRA速率抑制效应总体上高于其余盐度沉积物. 沉积物环境中AgNPs的粒径及浓度均是影响其毒性的重要因素: 当浓度不超过5 mg/L时, 10 nm粒径AgNPs毒性大于30 nm和100 nm粒径, 其在不同盐度沉积物中抑制率最高达16.03%、20.27%和15.36%; 但当AgNPs浓度为10 mg/L时, 30 nm和100 nm粒径的AgNPs对DNRA速率抑制程度明显增大, 毒性效应大于10 nm粒径AgNPs, 不同盐度沉积物中最大抑制率分别为17.48%、33.18%和26.45%. AgNPs释放的Ag+ 浓度与DNRA速率的抑制率未存在显著的正相关关系(p > 0.05), 反映AgNPs释放的Ag+对DNRA存在一定的抑制作用, 但并不能完全解释AgNPs的毒性作用特征. 研究结果对于客观评价金属纳米材料对河口氮循环的潜在影响具有重要科学意义.Abstract: Human activity can cause accumulation of silver nanoparticles (AgNPs) in estuarine and coastal environments; however, the effects of accumulated AgNPs on nitrogen transformation remain unclear. This study investigated the effects of AgNPs on dissimilatory nitrate reduction to ammonium (DNRA) rates in Yangtze estuarine and intertidal sediments using exposure experiments with three different sizes of AgNPs (10 nm, 30 nm, and 100 nm) and three different AgNPs concentrations (0.1 mg/L, 5 mg/L, and 10 mg/L). The results showed that AgNPs inhibited DNRA rates of sediments with different salinity levels, but the inhibition did not increase significantly with time. AgNPs had relatively high inhibition in medium salinity areas depending on the physical properties of the respective sediments. Moreover, it was shown that both the size and concentration of AgNPs were important factors affecting their toxicity. When the concentration of AgNPs was ≤ 5 mg/L, the inhibition of 10 nm AgNPs on the DNRA rate was greater than those of 30 nm and 100 nm AgNPs; the strongest inhibition effects among different salinities reached 16.03% (at 0.2‰ salinity), 20.27% (at 8.0‰ salinity), and 15.36% (at 20‰ salinity). However, when the concentration of AgNPs was 10 mg/L, the inhibition of 30 nm and 100 nm AgNPs on the DNRA rate under the same salinities increased to 17.48%, 33.18%, and 26.45%, respectively; these values were larger than the inhibition of 10 nm AgNPs. There was no significant correlation between Ag+ concentration and the inhibition of AgNPs on the DNRA rate (p > 0.05), indicating the inhibitory effect of AgNPs on the DNRA rate could not be fully explained by the toxicity of Ag+. These results are of great significance to understand the influence of emerging pollutants on the estuarine nitrogen cycle.
-
Key words:
- silver nanoparticles /
- DNRA /
- size /
- salinity /
- Yangtze Estuary
-
表 1 沉积物DNRA速率与环境因子的相关性分析
Tab. 1 Correlation analyses between environmental factors and DNRA rates in the sediment
粒径 NH4+ NO3– NO2– TOC 硫化物 相关系数 0.003 0.018 0.209 0.011 0.174 0.105 p 值 0.767 0.480 0.011 0.588 0.022 0.013 表 2 AgNPs粒径、AgNPs浓度和沉积物盐度对DNRA速率变化率的多因素方差分析
Tab. 2 Multivariate ANOVA analyses of percentage changes in DNRA rates with AgNPs sizes, AgNPs concentration, and sediment salinity
自由度df 均方MS F 值 p 值 AgNPs 粒径 2 17.806 2.665 0.043 沉积物盐度 2 59.699 3.003 0.054 AgNPs 浓度 2 976.933 30.941 0.011 AgNPs 粒径 × 盐度 4 4.252 0.214 0.930 AgNPs 粒径 × AgNPs 浓度 4 72.246 3.634 0.008 AgNPs 浓度 × 盐度 4 59.163 2.976 0.022 AgNPs 粒径 × 盐度 × AgNPs 浓度 8 10.162 0.511 0.846 -
[1] YIN G, HOU L, LIU M, et al. Effects of thiamphenicol on nitrate reduction and N2O release in estuarine and coastal sediments [J]. Environmental Pollution, 2016, 214: 265-272. DOI: 10.1016/j.envpol.2016.04.041. [2] YIN G, HOU L, LIU M, et al. DNRA in intertidal sediments of the Yangtze Estuary [J]. Journal of Geophysical Research: Biogeosciences, 2017, 122(8): 1988-1998. DOI: 10.1002/2017JG003766. [3] VANCE M E, KUIKEN T, VEJERANO E P, et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory [J]. Beilstein J Nanotechnol, 2015(6): 1769-1780. [4] MUELLER N C, NOWACK B. Exposure modeling of engineered nanoparticles in the environment [J]. Environmental Science & Technology, 2008, 42(12): 4447-4453. [5] MCWILLIAMS J K. Characterizing the biochemical and toxicological effects of nanosilver in vivo using zebrafish (Danio rerio) and in vitro using rainbow trout (Oncorhynchus mykiss) [R]. Ottawa: University of Ottawa, 2014. [6] 唐诗璟, 郑雄, 陈银广. 水体环境中纳米银的来源、迁移转化及毒性效应的研究进展 [J]. 化工进展, 2013(11): 2727-2733. [7] FABREGA J, LUOMA S N, TYLER C R, et al. Silver nanoparticles: behaviour and effects in the aquatic environment [J]. Environment International, 2011, 37(2): 517-531. DOI: 10.1016/j.envint.2010.10.012. [8] 李墨青. 纳米银对SBR系统水处理效能及微生物菌群的影响研究 [D]. 哈尔滨: 哈尔滨工业大学, 2014. [9] LIANG Z, DAS A, HU Z. Bacterial response to a shock load of nanosilver in an activated sludge treatment system [J]. Water Research, 2010, 44(18): 5432-5438. DOI: 10.1016/j.watres.2010.06.060. [10] 张汝嘉. 纳米银对硝化细菌以及SBR反应器中的活性污泥的抑制作用的研究 [D]. 哈尔滨: 哈尔滨工业大学, 2010. [11] ZHENG Y, HOU L. Effects of silver nanoparticles on nitrification and associated nitrous oxide production in aquatic environments [J]. Science Advances, 2017, 3(8): e1603229. DOI: 10.1126/sciadv.1603229. [12] CHOI O, HU Z Q. Size dependent and reactive oxygen species related nanosilver toxicity to nitrifying bacteria [J]. Environmental Science & Technology, 2008, 42(12): 4583-4588. [13] BEDDOW J, STOLPE B, COLE P A, et al. Nanosilver inhibits nitrification and reduces ammonia-oxidising bacterial but not archaeal amoA gene abundance in estuarine sediments [J]. Environmental Microbiology, 2017, 19(2): 500-510. DOI: 10.1111/1462-2920.13441. [14] LIU S, WANG C, HOU J, et al. Effects of Ag and Ag2S nanoparticles on denitrification in sediments [J]. Water Research, 2018, 137: 28-36. DOI: 10.1016/j.watres.2018.02.067. [15] VANDEVOORT A R, ARAI Y. Effect of silver nanoparticles on soil denitrification kinetics [J]. Industrial Biotechnology, 2012, 8(6): 358-364. DOI: 10.1089/ind.2012.0026. [16] ZHENG Y, JIANG X, HOU L, et al. Shifts in the community structure and activity of anaerobic ammonium oxidation bacteria along an estuarine salinity gradient [J]. Journal of Geophysical Research: Biogeosciences, 2016, 121(6): 1632-1645. DOI: 10.1002/2015JG003300. [17] BARGU S, WHITE J R, LI C, et al. Effects of freshwater input on nutrient loading, phytoplankton biomass, and cyanotoxin production in an oligohaline estuarine lake [J]. Hydrobiologia, 2011, 661(1): 377-389. DOI: 10.1007/s10750-010-0545-8. [18] YIN G, HOU L, LIU M, et al. A novel membrane inlet mass spectrometer method to measure 15NH4+ for isotope-enrichment experiments in aquatic ecosystems [J]. Environmental Science & Technology, 2014, 48(16): 9555-9562. [19] HOU L J, LIU M, XU S Y, et al. The effects of semi-lunar spring and neap tidal change on nitrification, denitrification and N2O vertical distribution in the intertidal sediments of the Yangtze estuary, China [J]. Estuarine Coastal and Shelf Science, 2007, 73(3/4): 607-616. [20] 代岚. 硫化物测定的主要影响因素 [J]. 辽宁化工, 2009, 38(11): 838-839. DOI: 10.3969/j.issn.1004-0935.2009.11.024. [21] YANG Y, LI M, MICHELS C, et al. Differential sensitivity of nitrifying bacteria to silver nanoparticles in activated sludge [J]. Environmental Toxicology and Chemistry, 2014, 33(10): 2234-2239. DOI: 10.1002/etc.2678. [22] YU Y, JING W, XIU Z M, et al. Impacts of silver nanoparticles on cellular and transcriptional activity of nitrogen-cycling bacteria [J]. Environmental Toxicology & Chemistry, 2013, 32(7): 1488-1494. [23] CHEN J, TANG Y, LI Y, et al. Impacts of different nanoparticles on functional bacterial community in activated sludge [J]. Chemosphere, 2014, 104: 141-148. DOI: 10.1016/j.chemosphere.2013.10.082. [24] 白洁, 田延昭, 孙鹏飞, 等. 纳米银对胶州湾西北部海区及河口区沉积物反硝化能力和功能基因丰度的影响 [J]. 环境科学, 2018, 39(11): 4956-4963. [25] 郭志. 纳米银的环境毒理及其潜在的应用研究 [D]. 长沙: 湖南大学, 2017. [26] XIU Z, ZHANG Q, PUPPALA H L, et al. Negligible particle-specific antibacterial activity of silver nanoparticles [J]. Nano Letters, 2012, 12(8): 4271-4275. DOI: 10.1021/nl301934w. [27] NATIONS S, WAGES M, CAÑAS J E, et al. Acute effects of Fe2O3, TiO2, ZnO and CuO nanomaterials on Xenopus laevis [J]. Chemosphere, 2011, 83(8): 1053-1061. DOI: 10.1016/j.chemosphere.2011.01.061. [28] YANG Y, WANG J, XIU Z, et al. Impacts of silver nanoparticles on cellular and transcriptional activity of nitrogen-cycling bacteria [J]. Environmental Toxicology and Chemistry, 2013, 32(7): 1488-1494. [29] LOK C, HO C, CHEN R, et al. Silver nanoparticles: partial oxidation and antibacterial activities [J]. Journal of Biological Inorganic Chemistry, 2007, 12(4): 527-534. DOI: 10.1007/s00775-007-0208-z. [30] 陶怡乐, 温东辉. 细菌硝酸盐异化还原成铵过程及其在河口生态系统中的潜在地位与影响 [J]. 微生物学通报, 2016, 43(1): 172-181. [31] WOODS D D. The reduction of nitrate to ammonia by Clostridium welchii [J]. Biochemical Journal, 1938, 32(11): 2000-2012. DOI: 10.1042/bj0322000. [32] TIEDJE J M, SEXSTONE A J, MYROLD D D, et al. Denitrification: ecological niches, competition and survival [J]. Antonie Van Leeuwenhoek, 1983, 48(6): 569-583. DOI: 10.1007/BF00399542. [33] RADNIECKI T S, STANKUS D P, NEIGH A, et al. Influence of liberated silver from silver nanoparticles on nitrification inhibition of Nitrosomonas europaea [J]. Chemosphere, 2011, 85(1): 43-49. DOI: 10.1016/j.chemosphere.2011.06.039. [34] 黄俊, 衣俊, 强丽媛, 等. 粒径和包裹物对纳米银在海洋微藻中的毒性影响 [J]. 环境科学, 2016, 37(5): 1968-1977. -




 下载:
下载: