Response of nitrogen removal in the overlying water to sediment resuspension in the intertidal wetlands of the Yangtze Estuary
-
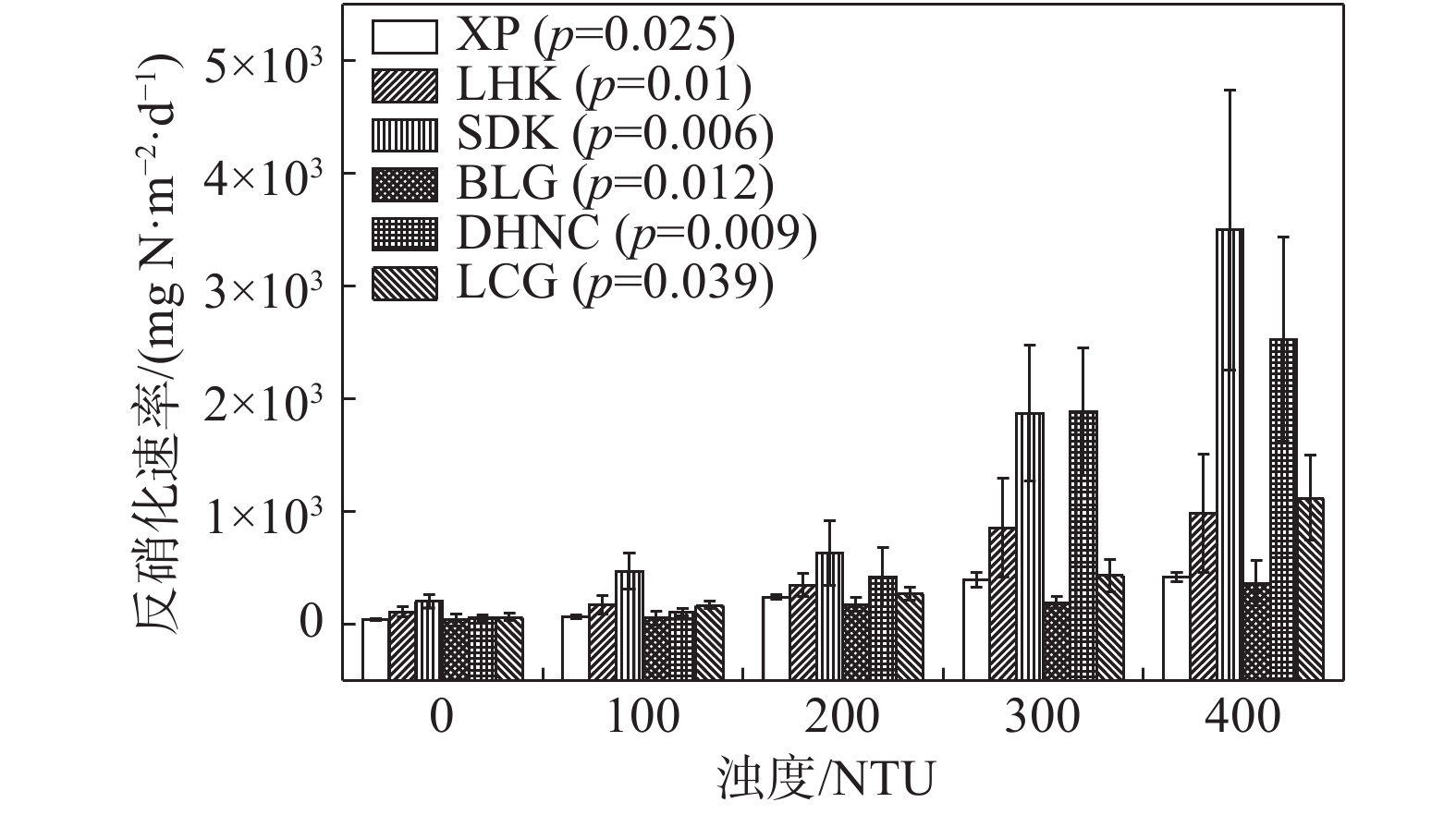
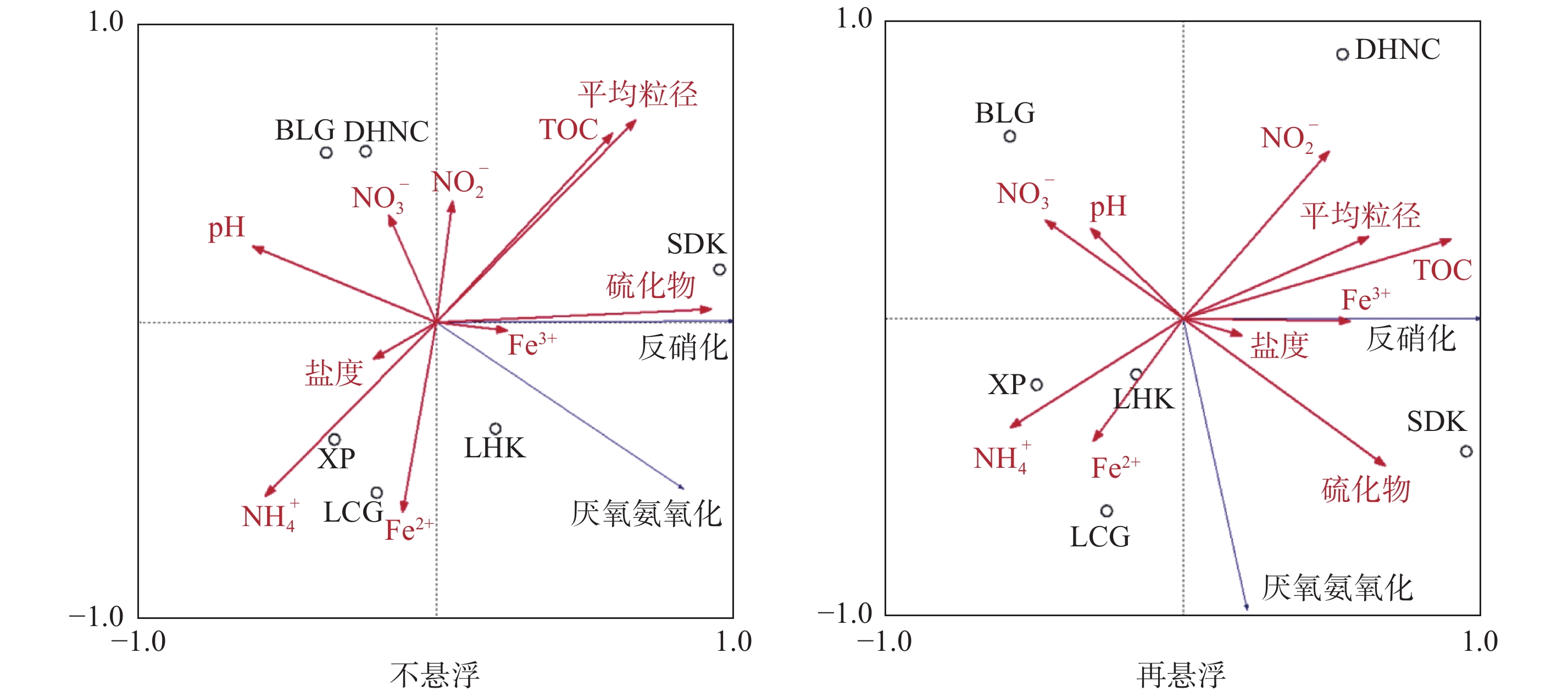
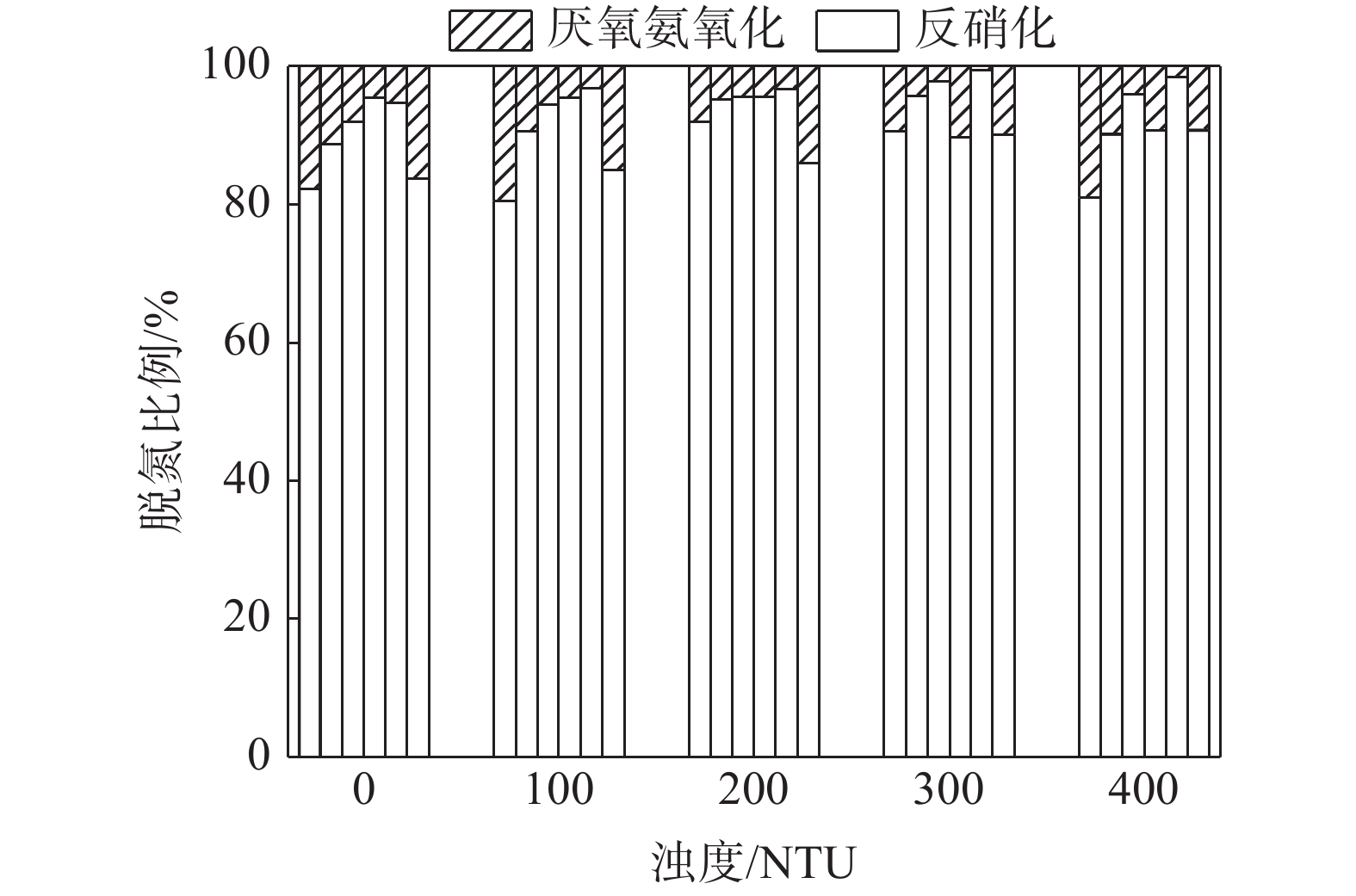
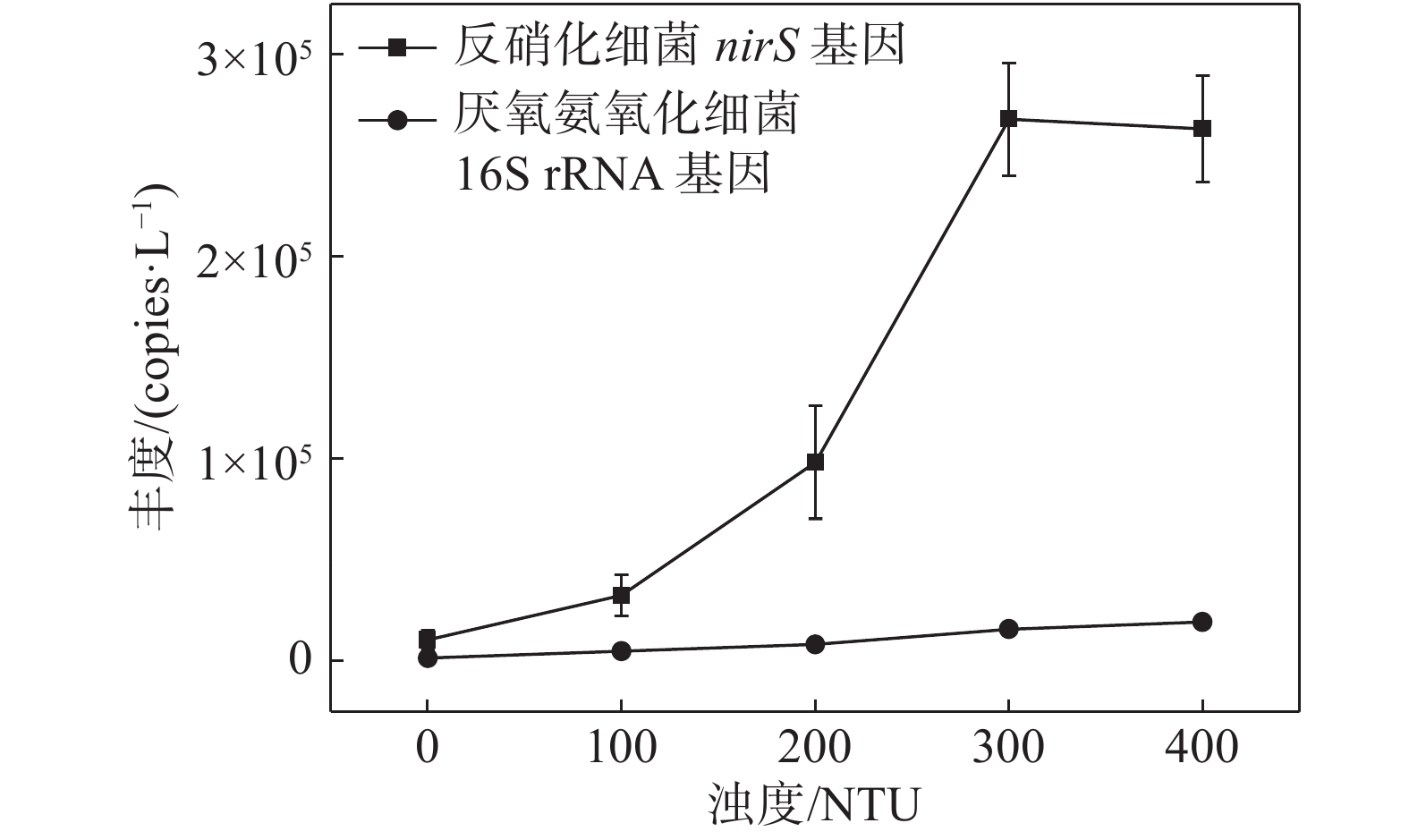
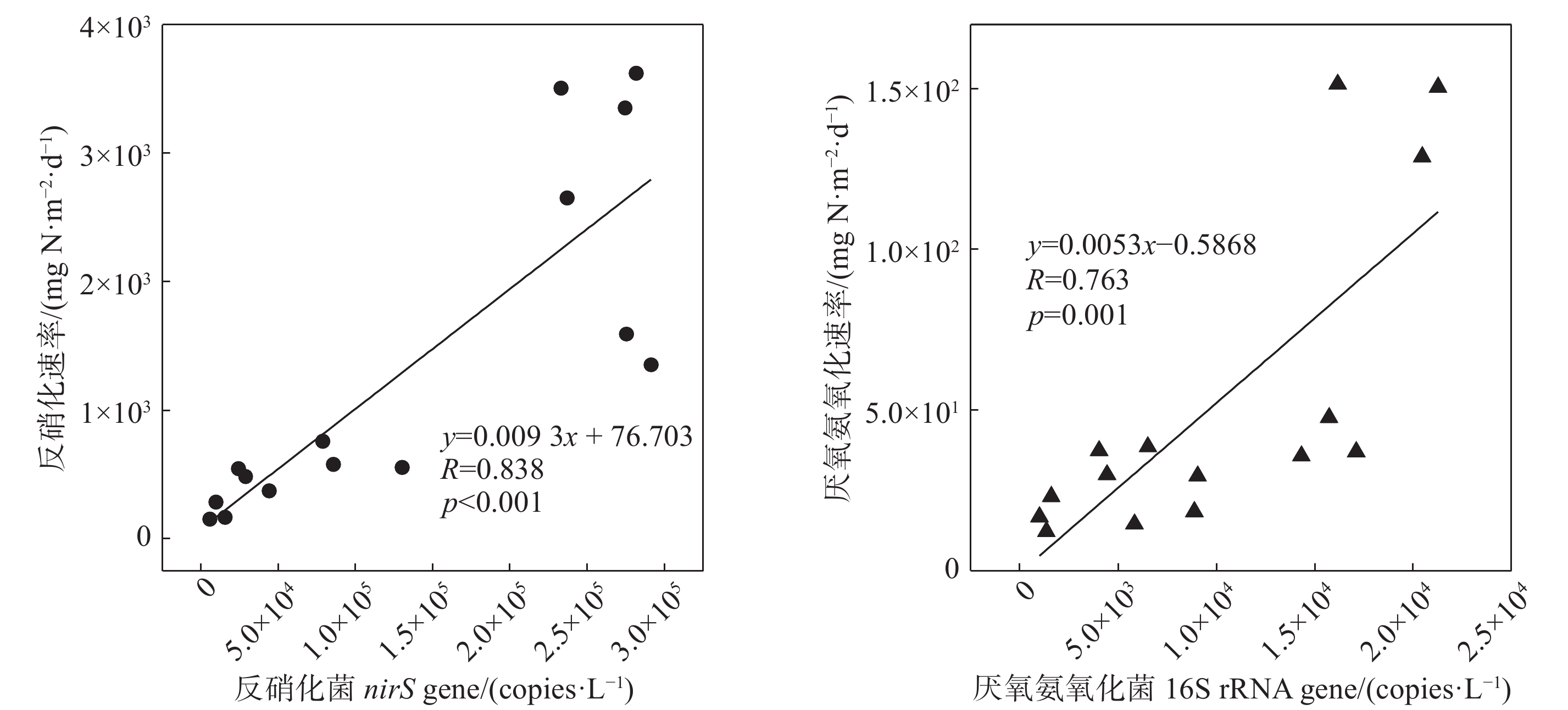
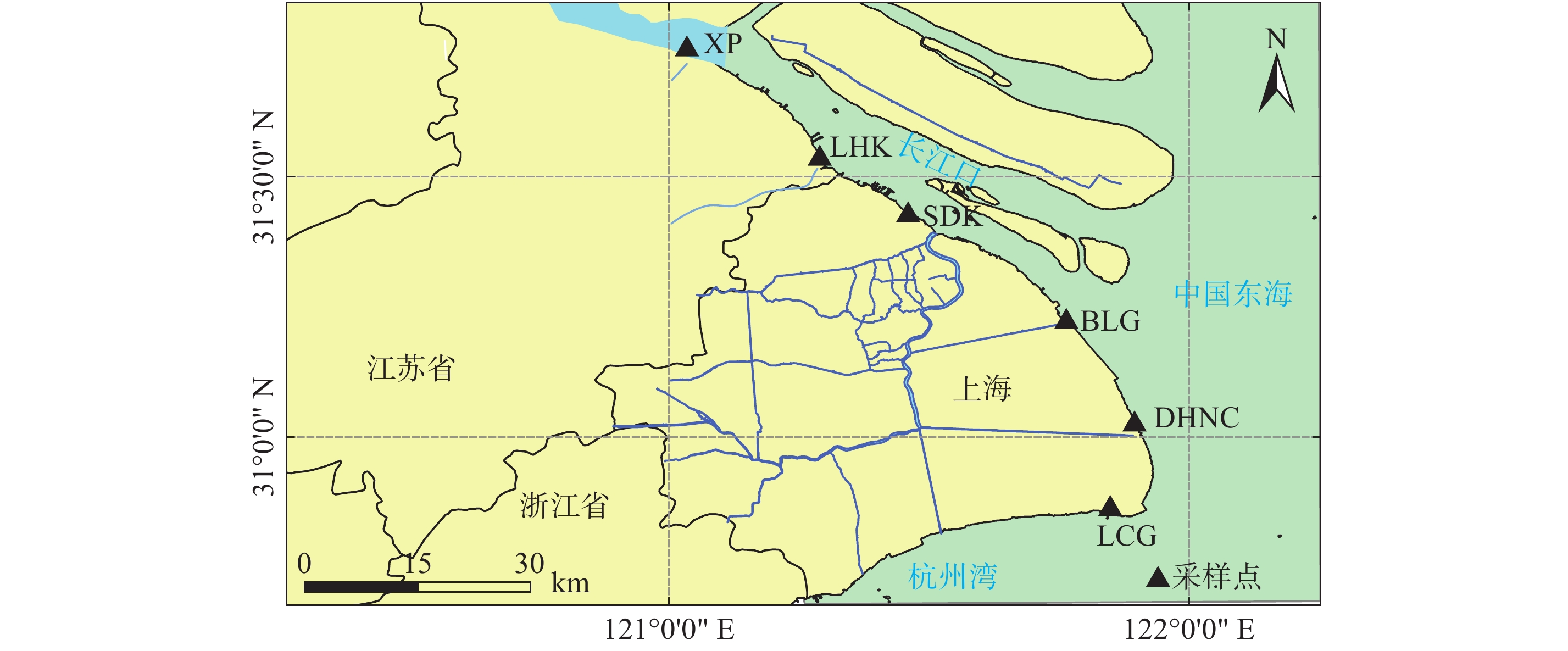
摘要: 以长江口潮滩作为研究区域, 采用15N同位素示踪技术, 模拟研究了沉积物再悬浮过程对水体反硝化和厌氧氨氧化的影响. 结果表明, 沉积物再悬浮引起的上覆水体反硝化和厌氧氨氧化速率与水体浊度呈显著的正相关关系, 这说明沉积物再悬浮能够促进水体脱氮过程的发生. 在沉积物再悬浮条件下, 采样点反硝化与厌氧氨氧化速率受不同站位理化因素的影响, 存在明显的空间差异, 且主要受沉积物总有机碳含量的控制. 此外, 随着沉积物再悬浮浊度的增加, 水体中反硝化细菌nirS基因与厌氧氨氧化细菌16S rRNA基因丰度均呈增加趋势. 这说明沉积物再悬浮可增加水体脱氮功能菌群的丰度, 进而增加脱氮速率. 研究结果表明, 评价河口潮滩沉积物再悬浮对氮转化过程的影响具有重要的科学意义.Abstract: The 15N isotope tracer technique was used to examine the response of denitrification and anammox to sediment resuspension in the intertidal wetlands of the Yangtze Estuary. The results showed that both denitrification and anammox rates were positively correlated with the turbidity of the overlying water, which demonstrates that sediment resuspension can promote the occurrence of nitrogen removal processes in overlying water. The denitrification and anammox rates showed significant spatial differences due to the physiochemical characteristics at different sites under sediment resuspension and was mainly attributed to the sediment TOC contents. In addition, the abundance of nirS and anammox bacterial 16S rRNA genes increased with suspended sediment turbidity, which indicates that sediment resuspension could increase the abundance of nitrogen removal functional bacteria, thus promoting nitrogen removal rates. These results indicate that sediment resuspension has important influence on nitrogen transformation processes and facilitates nitrogen removal in intertidal wetlands.
-
Key words:
- resuspension /
- turbidity /
- denitrification /
- anammox
-
表 1 采样点理化性质及微生物组成
Tab. 1 Physicochemical properties and microbial composition of sampling sites
采样点 盐度/
psupH 平均粒径/
μmFe2+/
(mg·g–1)Fe3+/
(mg·g–1)TOC/
(mg·g–1)硫化物/
(μg·g–1)NH4+/
(μmol·g–1)NO3–/
(μmol·g–1)NO2–/
(μmol·g–1)nirS/
(copies·g–1)16S rRNA/
(copies·g–1)XP 0.10 7.83 15.20 0.36 0.29 6.00 0.06 1.85 110.89 0.06 1.96×107 1.54×106 LHK 0.10 7.58 17.20 0.25 0.39 4.98 0.58 0.03 200.84 0.11 6.49×107 4.87×106 SDK 0.20 7.73 22.96 0.20 0.37 11.97 3.00 0.04 135.17 0.08 9.28×107 8.33×106 BLG 0.10 8.13 19.30 0.15 0.30 6.39 0.48 0.51 290.38 0.07 7.16×106 4.13×105 DHNC 0.60 8.01 17.96 0.18 0.43 10.39 0.08 0.31 110.77 0.14 9.73×106 8.41E×105 LCG 0.80 8.17 12.21 0.20 0.41 4.79 0.87 1.63 127.83 0.07 3.83×107 5.12E×106 -
[1] SEITZINGER S. Nitrogen cycle: Out of reach [J]. Nature, 2008, 452(7184): 162-163. DOI: 10.1038/452162a. [2] 鲍林林, 陈永娟, 王晓燕. 河流沉积物氮循环主要微生物的生态特征 [J]. 微生物学通报, 2015, 42(6): 1141-1150. [3] DENG F, HOU L, LIU M, et al. Dissimilatory nitrate reduction processes and associated contribution to nitrogen removal in sediments of the Yangtze Estuary [J]. Journal of Geophysical Research: Biogeosciences, 2015, 120(8): 1521-1531. DOI: 10.1002/2015JG003007. [4] WU J, CHEN N, HONG H, et al. Direct measurement of dissolved N2 and denitrification along a subtropical river-estuary gradient, China [J]. Marine Pollution Bulletin, 2013, 66(1/2): 125-134. [5] FELLOWS C S, CLAPCOTT J E, UDY J W, et al. Benthic metabolism as an indicator of stream ecosystem health [J]. Hydrobiologia, 2006, 572(1): 71-87. DOI: 10.1007/s10750-005-9001-6. [6] OAKES J M, EYRE B D, ROSS D J. Short-term enhancement and long-term suppression of denitrification in estuarine sediments receiving primary-and secondary-treated paper and pulp mill discharge [J]. Environmental Science & Technology, 2011, 45: 3400-3406. [7] 马培, 李新艳, 王华新, 等. 河流反硝化过程及其在河流氮循环与氮去除中的作用 [J]. 农业环境科学学报, 2014, 33(4): 623-633. DOI: 10.11654/jaes.2014.04.002. [8] LIU T, XIA X, LIU S, et al. Acceleration of denitrification in turbid rivers due to denitrification occurring on suspended sediment in oxic waters [J]. Environmental Science & Technology, 2013, 47(9): 4053-4061. [9] ZHANG S, XIA X, LIU T, et al. Potential roles of anaerobic ammonium oxidation (anammox) in overlying water of rivers with suspended sediments [J]. Biogeochemistry, 2017, 132(3): 237-249. DOI: 10.1007/s10533-017-0297-x. [10] 李雪, 刘苏彤, 梁红, 等. 温度对好氧颗粒污泥处理纤维素乙醇废水脱氮效能的影响 [J]. 环境科学学报, 2017, 37(4): 1436-1443. [11] RISGAARD-PETERSEN N, MEYER R L, REVSBECH N P. Denitrification and anaerobic ammonium oxidation in sediments: Effects of microphytobenthos and NO3– [J]. Aquatic Microbial Ecology, 2005, 40(1): 67-76. [12] GAO J, HOU L, ZHENG Y, et al. NirS-Encoding denitrifier community composition, distribution, and abundance along the coastal wetlands of China [J]. Applied microbiology and biotechnology, 2016, 100(19): 8573-8582. DOI: 10.1007/s00253-016-7659-5. [13] 韩建刚, 曹雪. 典型滨海湿地干湿交替过程氮素动态的模拟研究 [J]. 环境科学, 2013, 34(6): 2383-2389. [14] ZHENG Y, HOU L, NEWELL S, et al. Community dynamics and activity of ammonia-oxidizing prokaryotes in intertidal sediments of the Yangtze Estuary [J]. Appl Environ Microbiol, 2014, 80(1): 408-419. DOI: 10.1128/AEM.03035-13. [15] WANG J, DU J, BASKARAN M, et al. Mobile mud dynamics in the East China Sea elucidated using 210Pb, 137Cs, 7Be, and 234Th as tracers [J]. Journal of Geophysical Research: Oceans, 2016, 121(1): 224-239. DOI: 10.1002/2015JC011300. [16] HAMERSLEY M R, LAVIK G, WOEBKEN D, et al. Anaerobic ammonium oxidation in the Peruvian oxygen minimum zone [J]. Limnology and Oceanography, 2007, 52(3): 923-933. DOI: 10.4319/lo.2007.52.3.0923. [17] GARDNER W S, MCCARTHY M J. Nitrogen dynamics at the sediment-water interface in shallow, sub-tropical Florida Bay: Why denitrification efficiency may decrease with increased eutrophication [J]. Biogeochemistry, 2009, 95(2/3): 185-198. [18] YIN G, HOU L, ZONG H, et al. Denitrification and anaerobic ammonium oxidization across the sediment-water interface in the hypereutrophic ecosystem, Jinpu Bay, in the northeastern coast of China [J]. Estuaries and Coasts, 2015, 38: 211-219. DOI: 10.1007/s12237-014-9798-1. [19] GARCIA-ROBLEDO E, REVSBECH N P, RISGAARD-PETERSEN N, et al. Changes in N cycling induced by Ulva detritus enrichment of sediments [J]. Aquatic Microbial Ecology, 2013, 69(2): 113-122. DOI: 10.3354/ame01626. [20] PRETTY J L, HILDREW A G, TRIMMER M. Nutrient dynamics in relation to surface-subsurface hydrological exchange in a groundwater fed chalk stream [J]. Journal of Hydrology, 2006, 330(1/2): 84-100. [21] ENGSTRÖM P, DALSGAARD T, HULTH S, et al. Anaerobic ammonium oxidation by nitrite (anammox): Implications for N2 production in coastal marine sediments [J]. Geochimica et Cosmochimica Acta, 2005, 69(8): 2057-2065. DOI: 10.1016/j.gca.2004.09.032. [22] TRIMMER M, RISGAARD-PETERSEN N, NICHOLLS J C, et al. Direct measurement of anaerobic ammonium oxidation (anammox) and denitrification in intact sediment cores [J]. Marine Ecology Progress Series, 2006, 326: 37-47. DOI: 10.3354/meps326037. [23] TORTELL P D. Dissolved gas measurements in oceanic waters made by membrane inlet mass spectrometry [J]. Limnology and Oceanography, 2005, 3(1): 24-37. [24] 钱嫦萍, 陈振楼, 胡玲珍, 等. 崇明东滩沉积物再悬浮对沉积物-水界面氮、磷交换行为的影响 [J]. 环境科学, 2003, 24(5): 114-119. DOI: 10.3321/j.issn:0250-3301.2003.05.022. [25] XIA X, YANG Z, ZHANG X. Effect of suspended-sediment concentration on nitrification in river water: Importance of suspended sediment-water interface [J]. Environmental Science & Technology, 2009, 43(10): 3681-3687. [26] HOU L, ZHENG Y, LIU M, et al. Anaerobic ammonium oxidation (anammox) bacterial diversity, abundance, and activity in marsh sediments of the Yangtze Estuary [J]. Journal of Geophysical Research: Biogeosciences, 2013, 118(3): 1237-1246. DOI: 10.1002/jgrg.20108. [27] MEYER R L, RISGAARD-PETERSEN N, ALLEN D E. Correlation between anammox activity and microscale distribution of nitrite in a subtropical mangrove sediment [J]. Appl Environ Microbiol, 2005, 71: 6142-6149. DOI: 10.1128/AEM.71.10.6142-6149.2005. [28] JIA Z, LIU T, XIA X, et al. Effect of particle size and composition of suspended sediment on denitrification in river water [J]. Science of the Total Environment, 2016, 541: 934-940. DOI: 10.1016/j.scitotenv.2015.10.012. [29] 田胜艳, 张彤, 宋春诤, 等. 生物扰动对海洋沉积物中有机污染物环境行为的影响 [J]. 天津科技大学学报, 2016, 31(1): 1-7. [30] 李佳霖, 白洁, 高会旺, 等. 长江口海域夏季沉积物反硝化细菌数量及反硝化作用 [J]. 中国环境科学, 2009, 29(7): 756-761. DOI: 10.3321/j.issn:1000-6923.2009.07.016. -




 下载:
下载: